Sandrine CALVET-VITALE
Assistant Professor

Laboratoire de Chimie et Biochimie pharmacologiques et toxicologiques (LCBPT) – CNRS UMR 8601
Université Paris Descartes
45 Rue des Saints Pères
75270 Paris Cedex 06
France

Sandrine CALVET-VITALE
Assistant Professor
Chemistry towards life sciences
Pharmacologiques et Toxicologiques (LCBPT)
CNRS UMR 8601
Université Paris Descartes
45 Rue des Saints Pères
75270 Paris Cedex 06
France
Curriculum Vitae
- Maître de Conférences (2007 – …) – Université Paris Descartes- UMR 8601.
- Stage post-doctoral (2007) – Université Paris Descartes “Conception et synthèse de nouveaux analogues des bengamides : inhibiteurs potentiels des méthionine aminopeptidases à la recherche d’une activité anti-tumorale” (Financement ARC), sous la direction du Pr H. Dhimane (UMR 8601, Equipe Synthèse de composés d’intérêt biologique).
- Stage post-doctoral (2006) – Université d’Amsterdam “Vers des librairies de petits cyclopeptides”, sous la direction du Pr H. Hiemstra et du Dr J.H. van Maarseveen, Van ‘t Hoff Institute for Molecular Sciences.
- Thèse en Chimie Organique (2005) – Université Pierre et Marie Curie “Nouvelles voies d’accès à des énaminoesters hétérocycliques chiraux. Application à la synthèse de pyrrolidines et de pipéridines fonctionnalisées”, sous la direction du Pr G. Lhommet et du Dr C. Vanucci-Bacqué (Laboratoire de Chimie Organique).
Thème de recherche
Chimie médicinale – Conception et synthèse de nouveaux inhibiteurs des transférases bactériennes MraY.
Le phénomène de résistance aux antibiotiques est un grave problème de santé publique. Une des méthodes pour lutter contre les souches résistantes, et retarder le phénomène de résistance, est de créer de nouvelles classes d’antibiotiques dirigés contre des enzymes qui n’ont pas encore été ciblées par des médicaments. La transférase MraY est impliquée dans la première étape membranaire de la biosynthèse du peptidoglycane. Cet enzyme est spécifique du monde bactérien, n’est actuellement visée par aucun médicament et constitue une cible prometteuse pour la découverte de nouveaux antibiotiques.
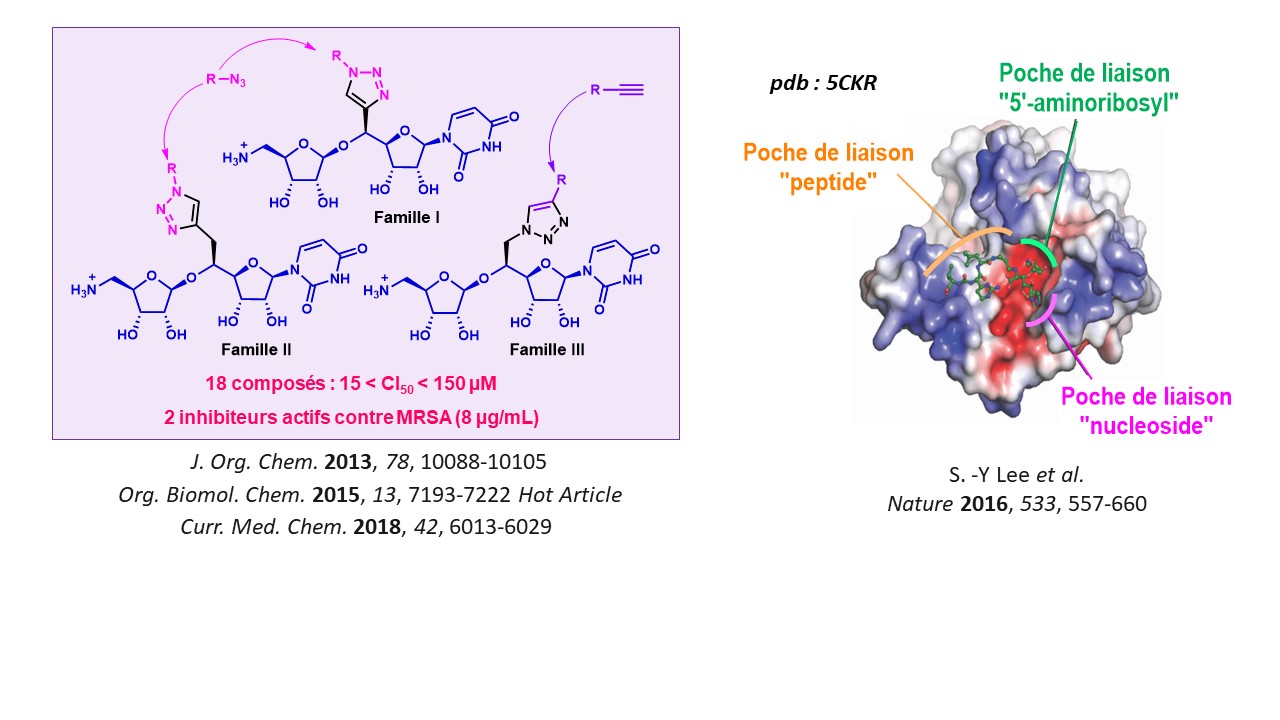
Nous mettons au point des voies de synthèse convergentes permettant un accès rapide à des molécules de structure complexe. Une première série de composés comportant un cycle triazole a fourni des inhibiteurs possédant des CI50 très encourageantes. A partir de la structure cristallographique du complexe MraY : Muraymycine D2, publiée par le groupe de S.-Y. Lee en 2016, nous nous appuyons sur des études de modélisation moléculaire pour proposer de nouvelles structures destinées à occuper de façon optimale le site actif de MraY.
Publications
2019
2018
2017
- Ben Othman, R. ; Fer, M. J. ; Le Corre, L. ; Calvet-Vitale, S.* ; Christine Gravier-Pelletier, C.* Effect of uridine protecting groups on the diastereoselectivity of uridine-derived aldehyde 5′-alkynylation, Beilstein J. Org. Chem. 2017, 13, 1533-1541.
